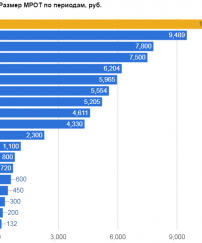
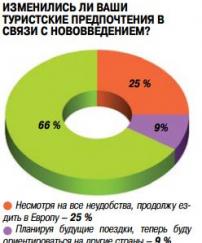
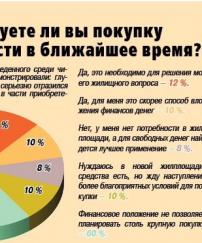
Данная поправка к закону «Об обращении лекарственных средств» вступит в силу летом 2015 года.
«В поправке к статье 18 говорится, что если определенный препарат признается орфанным, то на стадии его регистрации не требуются проводить клинические исследования в РФ. Можно представить результаты международных исследований, но они должны соответствовать общемировым стандартам. Это очень важный момент, так как, выступая за упрощение порядка регистрации, мы не должны создавать неконтролируемое окно для появления непроверенных препаратов. А такие прецеденты были. Поэтому уверенность в качестве клинических исследований должна быть, и в законе об этом прямо говорится», – рассказывает представитель пациентского сообщества Юрий Жулев.
Отменены клинические испытания для регистрации орфанных заболеваний
25 февраля на открытом заседании Совета общественных организаций по защите прав пациентов при Минздраве России сообщили, что регистрация препаратов для лечения орфанных заболеваний будет проходить без клинических испытаний. Они представляют собой группу редких болезней, обусловленных генетическими отклонениями.
-
 26.02. 16:29
ээээ (Гость)
И что такое орфанные заболевания?? пишите понятнее!
26.02. 16:29
ээээ (Гость)
И что такое орфанные заболевания?? пишите понятнее!