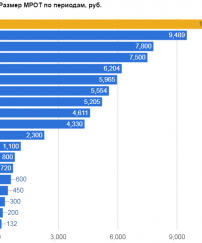
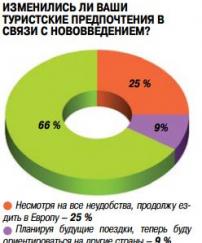
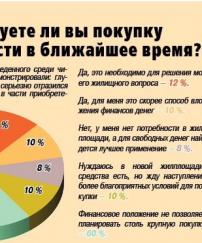
Неутешительные результаты
В 2009 году правительство РФ предприняло инициативу усовершенствовать закон «Об обращении лекарственных средств», который был принят еще в 1998 году, с учетом мировых стандартов ведущих организаторов КИ. Поводом послужила совместная инспекция Росздравнадзора с FDA США, проводившаяся с октября по декабрь 2009 года и направленная на выявление нарушений при проведении исследований. Результаты неутешительны: крупные специализированные центры не смущаются пренебрегать законодательными инициативами при подготовке программ КИ. Также выявлены несоответствия сроков выполнения запланированных исследований, ошибки при заполнении электронных карт пациентов и нарушения ведения учета исследуемых лекарственных средств.
В своем заключении эксперты отметили, что слабо проработанный механизм контроля со стороны государственных органов власти ограничивает возможность увеличения КИ на территории страны, не говоря уже о том, чтобы привлекать большее количество пациентов для тестирования препаратов.
Руководитель Росздравнадзора Николай Юргель отметил, что для устранения всех заявленных нарушений в 2010 году планируется «проверить базы, где проводятся клинические исследования, расположенные не только в Москве и Санкт-Петербурге, но и в других регионах. Будет проведена подготовка и аттестация врачей-исследователей и других специалистов, участвующих в проведении клинических исследований».
Кого пугают перемены?
Вступившие в силу изменения в законе «Об обороте лекарственных средств» коснулись следующих пунктов:
● Государственная регистрация цен на жизненно необходимые и важнейшие лекарственные средства (ЖНВЛС).
● Ограничение срока государственной регистрации нового лекарства до 210 рабочих дней.
● Медицинские учреждения смогут закупать лекарства у производителей, минуя дистрибьюторов.
● Обеспечение до 2014 года соответствия технологических процессов международным стандартам надлежащей производственной практики.
Заключительная часть законопроекта коснулась порядка проведения КИ: их осуществление возможно только после обязательного страхования жизни пациентов. Компании будут обязаны предоставлять договор страхования всех пациентов для получения разрешения на исследования. При этом надзор за деятельностью организаций при проведении исследований будет входить в компетенцию Минздравсоцразвития.
Ценовая «дискриминация»
Нововведения существенно осложнят жизнь фармацевтических компаний: придется ждать разрешения несколько месяцев, а угроза приостановки клинических исследований становится вполне реальной. Так, предыдущие версии закона предполагали введение в аптечный оборот испытуемых препаратов, произведенных за границей только после обязательного участия в КИ российских пациентов без дополнительных процедур страхования. Специалисты Ассоциации организаций по КИ говорят, что новый законопроект точно не устанавливает, на какой фазе испытаний обязательно участие наших соотечественников.
Еще одна сложность – увеличение требований к опыту руководителя исследований: от 3 до 5 лет. Количество базовых клиник при таком новом требовании закона в России может уменьшиться, возможны и проблемы при аккредитации учреждений для проведения КИ.
Кроме того, в ходе дальнейших проверок начали выявляться и нарушения в области ценообразования на ЖНВЛС. Так, ФАС выяснила, что цены на препараты с одинаковым международным непатентованным наименованием (МНН), то есть названием действующего вещества, часто отличаются, порой даже в десятки раз. При этом сами фармкомпании не могут предоставить обоснованных схем ценообразования.
Сами эксперты фармрынка оправдывают подобные меры нехваткой времени на перерегистрацию лекарственных препаратов. На это у сотрудников ФАС свои, более простые объяснения: дистрибьюторам интереснее работать с дорогими препаратами, потому что оптовая и розничная надбавка на них выше.
Обратная сторона медали
Конечно, у этой проблемы есть и другая сторона – административные барьеры: введение понятия «государственной экспертизы научной обоснованности и целесообразности проведения клинических исследований лекарственного препарата», которая фактически не несет никакой ответственности за последствия принятия неправильного решения.
Еще один «минус» – затягивание сроков на получение разрешения (в законопроекте — 90 дней), превышающих установленные европейским законодательством 60 календарных дней. Учитывая, что это немаловажный фактор при принятии решения о возможности размещения международных мультицентровых клинических исследований в той или иной стране, Россия может стать менее привлекательной в инвестиционном плане.
Недоумение вызывает у специалистов и требование аккредитации лечебных учреждений для проведения КИ. Международная практика не требует для этого наличия специальных лицензий: фактически это дополнительный административный барьер.
Примеры халатности фармпроизводителей показывают, что несовершенство законодательства становится серьезным барьером для увеличения испытаний на территории страны. Между тем, коммерческий эффект от этого вида деятельности способен внести существенный вклад в федеральный бюджет, а социальные результаты позволили бы вывести РФ на один уровень с мировыми лидерами производства лекарств.
Лекарственная экономика
8 сентября 2010 / просмотров – 1931
Экономика
С 1 сентября 2010 года вступила в силу новая редакция закона «Об обороте лекарственных средств», которая призвана усовершенствовать механизм проведения клинических испытаний (КИ) на территории нашей страны с участием российских пациентов.